
秦皇岛铝单板厂家哪家好失之东隅收之桑榆(免疫治疗pd1是什么)
发布时间:2023-04-30 11:54:28 人气:42 来源:铝单板厂家
原标题:肿瘤免疫风云涌动,双抗挑战PD-1/PD-L1,开启免疫2.0时代作者:找药宝典NSCLC占肺癌的80% - 85%,腺癌和鳞状细胞癌是最常见的NSCLC组织学亚型CPIs彻底改变了非小细胞肺癌的治疗,抗PD-1/PD-L1的免疫疗法已展现巨大前景,基于此的联合疗法探索也带来了更多的生存获益。
血管内皮生长因子(VEGF)广泛表达于实体瘤,不仅可促进肿瘤血管生成,还会抑制抗肿瘤免疫效应AK112是由康方生物完全独立自主研发的全球首创的PD-1/VEGF双特异性抗体新药,可抑制PD-1介导的免疫抑制,同时阻断肿瘤微环境中的血管生成,展现出强大的抗肿瘤效应。
AK112单药治疗晚期NSCLC该研究是AK112单药一线或二线治疗晚期NSCLC的多中心、开放标签、Ib/II期临床试验(AK112-202研究)在初治或一线含铂化疗治疗进展的NSCLC患者中,评估AK112不同给药方案治疗晚期NSCLC的有效性和安全性。
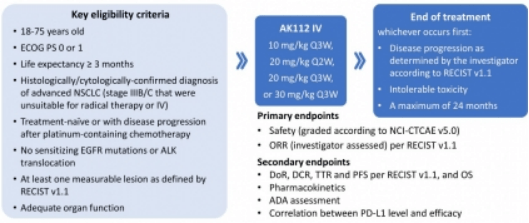
研究结果显示,AK112单药治疗晚期NSCLC显示出良好的安全性和耐受性在初治且PD-L1表达阳性(TPS≥1%)的患者(n=35)中,接受>10mg/kg Q3W AK112治疗患者的ORR(客观缓解率)为60%,DCR(疾病控制率)为97.1%。
在PD-L1高表达(TPS≥50%)患者的ORR为76.9%,DCR为100%由此可见,AK112对不同PD-L1表达水平患者均有良好的抗肿瘤疗效AK112联合化疗治疗晚期NSCLC该项研究是AK112联合化疗治疗晚期非小细胞肺癌患者的II期临床研究(NCT04736823)。
旨在评估AK112联合化疗治疗晚期非小细胞肺癌患者的安全性和有效性研究分为3个队列,共计划入组约80例受试者,设置安全导入期和扩展入组期
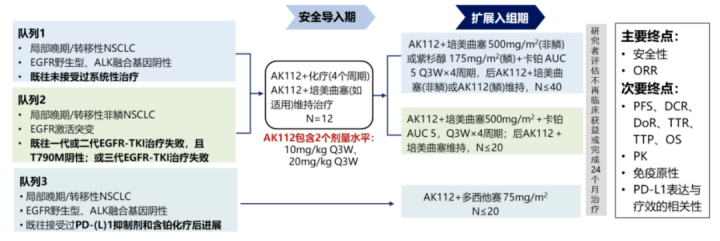
结果显示,在队列1中,在26名可评估的鳞状细胞癌患者中,观察到20名部分缓解和6名疾病稳定,ORR为76.9%,DCR为100.0%;在队列 2 中,在19名可评估的患者中,观察到13名部分缓解和5名疾病稳定,ORR为68.4%,DCR为94.7%;在队列3中,在20名可评估的患者中,观察到8名部分缓解和8名疾病稳定,ORR为40.0%,DCR为80.0%。
AK112联合化疗在各队列中都显示出有希望的抗肿瘤疗效,并且相较于PD-1/PD-L1单抗联合化疗+/-抗血管生成药物疗法,更具优势的安全性和耐受性AK112头对头比较替雷利珠单抗4 月 26 日,药物临床试验登记与信息公示平台显示,康方生物启动了一项其 AK112(PD1/VEGF 双抗)联合化疗对比 PD-1 抑制剂联合化疗一线治疗局部晚期或转移性鳞状非小细胞肺癌的 III 期临床研究。
这是一项随机、双盲、对照、多中心的 III 期临床,旨在评估 AK112 联合化疗(卡铂 + 紫杉醇)与替雷利珠单抗联合化疗在局部晚期或转移性鳞状非小细胞肺癌患者中的有效性和安全性主要终点指标是独立影像评估委员会(IRRC)基于实体瘤疗效评价标准 1.1 版(RECIST v1.1)评估的无进展生存期(PFS)。
AK112头对头比较帕博利珠单抗近日,康方生物在 ClinicalTrials.gov 登记了一项针对晚期非小细胞肺癌的随机对照、多中心、Ⅲ期临床研究(登记号:NCT05499390),目的是评估 AK112 在PD-L1表达阳性(TPS≥1%)的晚期 NSCLC 患者中与 帕博利珠单抗 对比的疗效和安全性。
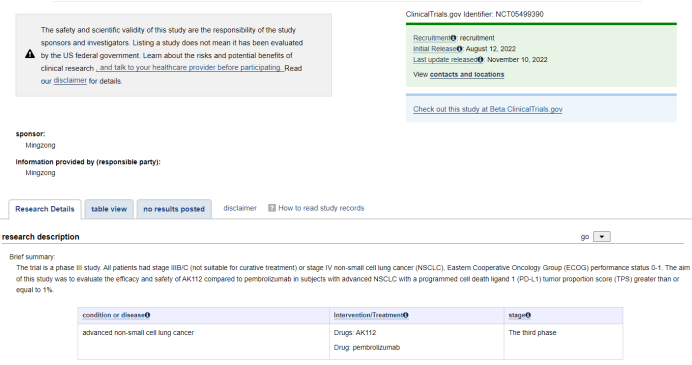
该研究计划共纳入 388 名受试者,随机分组接受 AK112(静脉注射)和帕博利珠单抗每三周静脉注射200 mg治疗主要终点是独立影像评估委员会(IRRC)按照 RECIST v1.1 标准评估的PFS,次要终点包括总生存期(OS)、ORR、DoR(缓解持续时间)等。
此外,康方生物还正在开展AK112联合化疗对比单独化疗在EGFR-TKI耐药的EGFR突变的晚期非鳞状NSCLC的III期研究(NCT05184712)除此之外,还有一些双抗也取得了很好的疗效康方生物的PD-1/CTLA-4双抗AK104。
2022年6月29日,国家药监局(NMPA)附条件批准康方生物自主研发的PD-1/CTLA-4双特异性抗体药物开坦尼(卡度尼利单抗注射液)上市,用于治疗复发或转移性宫颈癌(R/M CC)这是国内获批上市的首款双抗药物,也全球获批的首款PD-1/CTLA-4双抗。
卡度尼利单抗此次获批是基于一项卡度尼利单药用于既往接受含铂化疗治疗失败的复发或转移性宫颈癌的Ⅱ期关键性临床研究结果显示,经IRRC确认的ORR为33.0%,其中完全缓解(CR)率为12.0%,6个月和12个月DoR率分别为77.6%和52.9%。
中位PFS为3.75个月,中位OS为17.51个月亚组分析中,在PD-L1阳性(CPS≥1)患者中,ORR为43.8%,中位PFS为6.34 个月,中位OS未达到安全性方面上,≥3级TRAE发生率为27.0%。
康宁杰瑞的PD-1/CTLA-4双抗KN046KN046是康宁杰瑞自主研发的PD-L1/CTLA-4双特异性抗体2020年9月3日,获美国FDA授予孤儿药资格,用于治疗胸腺上皮肿瘤 2020年8月,KN046在中国获得一项临床试验默示许可,拟开发适应症为:联合甲苯磺酸多纳非尼片用于晚期消化道实体瘤的治疗。
同时,其联合含铂化疗针对IV期鳞状非小细胞肺癌的临床研究已正式进入3期试验阶段,该研究将用于KN046在中国的新药上市申报2020年12月23日,康宁杰瑞宣布,公司自主研发的抗HER2双特异性抗体KN026与PD-L1/CTLA-4双特异性单域抗体KN046联合疗法获美国FDA授予孤儿药资格,用于治疗HER2阳性或HER2低表达胃癌及胃食管连接部癌(GC/GEJ)。
信达生物&礼来的PD-1/PD-L1双抗IBI318IBI318是由信达生物和礼来制药集团共同研发的PD-1/PD-L1双抗,在去年的ASCO年会上,信达生物制药公布了IBI318在治疗晚期恶性肿瘤的1a期临床试验中的表现。
结果显示,IBI318有很好的耐受性,0.3mg到300mg的治疗组在没有发现剂量限制性毒性(DLT)其中11个患者出现发热和输液相关的反应(20.0%, G1/2),在300mg治疗组有一个患者出现免疫相关性不良事件(G2关节炎)。
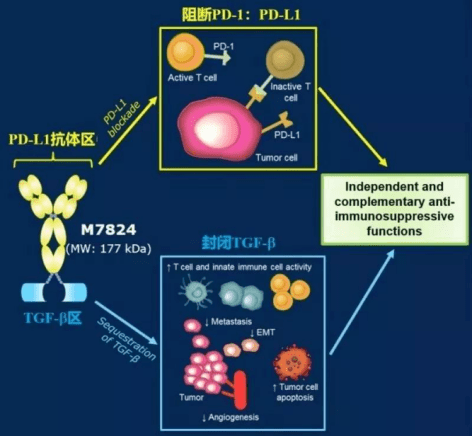
在9个接受≥10mg用药量患者中,有3个患者具有部分响应摸索中的药物研究总是起起伏伏,就在我们为迎来双抗时代而欢呼时,M7824在NSCLC和胆管癌的二次阴性结果,让我们再次理性看待双抗默沙东PDL1/TGF-β双抗M7824。
bintrafusp alfa(M7824)由Merck自主开发,是一种双功能的融合蛋白,为PDL1/TGF-β双抗,由两个部分构成的一端是能够识别结合PD-L1的抗体结构(Y),类似于T药、B药、I药等已经上市的PD-L1抗体;另一端是可以结合TGF-β的TGF-β受体II型融合蛋白(Trap),可以捕获TGF-β,从而减少肿瘤组织及其周围促癌的TGF-β。
在2018年ASCO,M7824二线治疗晚期NSCLC的结果公布,PD-L1阳性患者群体(PD-L1>1%)的总体缓解率ORR达到了40.7%(n=11/27)在PD-L1高表达 (PD-L1>80%)患者的ORR更是高达71.4%(n=5/7)!。
M7824在2线疗法治疗NSCLC的ORR达到86%,创下史上免疫单药疗效新高!基于初期研究结果,对M7824的期待很高,但是2021年1月20日,美通社(PR Newswire)发布:M7824一线治疗PD-L1高表达IV期非小细胞肺癌(NSCLC)Ⅲ期研究提前终止,分析显示无法击败默沙东的PD-1抗体K药,该研究不太可能达到 PFS 共同主要终点。
2018年12月,FDA授予M7824治疗胆管癌的孤儿药资格认定,获批基于同年10月ESMO大会上公布的M7824治疗胆管癌的最初数据:在接受铂类一线治疗后病情依然发展的亚洲患者中的临床活性通过IRC评估,全部30名患者的ORR为20%,并且在PD-L1水平上观察到对治疗的响应,DoR为8.3个月至13.9个月以上。
2019年更新的数据显示30名患者的ORR为23%,中位PFS为2.6个月,中位OS为12.7个月但是M7824单药治疗一线化疗失败或不耐受的晚期或转移性BTC患者的II期试验,结果显示,在超过9个月的随访后,独立审查委员会(IRC)根据RECIST v1.1标准判定ORR率为10.1% (95%CI, 5.9%-15.8%)。
尽管有明显的获益,但该试验没有达到预先设定的阈值虽然如此,但考虑到PD-L1单药免疫治疗BTC的ORR为5.8%左右,M7824作为二线治疗的单药临床活性仍然让人鼓舞声明:本资料中涉及的信息仅供参考,请遵从医生或其他医疗卫生专业人士的意见或指导。
本文版权归找药宝典所有,任何个人或机构转载需获得找药宝典授权,在授权范围内使用,并标注来源“找药宝典”本文转载自其他网站,不代表健康界观点和立场如有内容和图片的著作权异议,请及时联系我们(邮箱:guikequan@hmkx.cn)。
返回搜狐,查看更多责任编辑:
相关新闻
- 铝单板厂家联系电话号码高效便捷种类齐全(红米多少个系列) 2023-05-03
- 南昌铝单板厂家电话按照客户要求定制(realme 真我gt neo 5g怎么样) 2023-05-03
- 木纹铝单板厂家直销专业售后品质保证(红米快充多少钱一个) 2023-05-03
- 铝单板厂家排名及价格全国发货及时供应(redmi k60pro) 2023-05-03
- 铝单板厂家哪家好全国发货及时供应(红米note128g多少钱) 2023-05-03
- 铝单板厂家联系电话号码高效便捷种类齐全(红米多少个系列) 2023-05-03
- 承德铝单板厂家佛是金装人是衣装(波兰吞并切欣) 2023-05-02
- 张家口铝单板厂家哪家好塞翁失马焉知非福(英国老师几点上班) 2023-05-02
- 保定铝单板批发厂家养兵千日用兵一时(西安有几家世界500强企业) 2023-05-02
- 石家庄铝单板批发厂家一言既出驷马难追(中国在2030年的五大超级都市圈) 2023-05-02











 客服
客服